TİTCK'DAN İLAÇ FİRMALARININ DİKKATİNE DUYURU-18.01.2022
Sağlık Bakanlığı Türkiye İlaç ve Tıbbî Cihaz Kurumu tarafından İlaç firmalarının dikkatine duyuru yayımlandı.

18 Ocak 2022 Salı 12:30
RD/2022/1/1 Tüm İlaç Firmaların Dikkatine
11.12.2021 tarih ve 31686 sayılı Resmi Gazetede Beşeri Tıbbi Ürünler Ruhsatlandırma Yönetmeliği yayımlanmıştır. Bu kapsamda Başvuru Formu ve CTD Kılavuzu güncellenmiştir.
Yapılan güncellemeler aşağıda sıralanmıştır:
1- Ruhsatlı beşeri tıbbi ürünlerdeki varyasyonlara dair yönetmelik Ek I’e atıfta bulunan çeşitleme başvuru türü güncellenmiştir.
2- "Bibliyografik başvuru" ismi "yerleşmiş tıbbi kullanım başvurusu" olarak güncellenmiştir.
3- Kısaltılmış başvurular altında verilen "jenerik başvuru" ismi "eşdeğer tıbbi ürün başvurusu" olarak güncellenmiştir.
4- Kısaltılmış başvurular altında verilen "Son paragraf" başvuru türü kaldırılmıştır.
5- Hibrit başvuru, ilişkili alerjen ürün başvuru türü eklenmiştir.
6- Sabit kombinasyon başvurusu iki bölüme ayrılmıştır.
7- Öncelikli değerlendirme, koşullu ruhsatlandırma ve istisnai ruhsatlandırma başvuruları eklenmiştir.
8- Ruhsat başvuru ayrıntılarına "Tıbbi cihazlar" bölümü eklenmiştir.
Çeşitleme ve ilişkili alerjen ürün başvuru türü ile ilgili kılavuz yayımlanacaktır.
Beşeri Tıbbi Ürünler Ruhsatlandırma Yönetmeliği 9 uncu maddesinin birinci fıkrasının (b) bendi doğrultusunda hibrit başvuru;
- Beşeri tıbbi ürün için eşdeğer tıbbi ürün tanımının tam karşılanmadığı veya
- Biyoeşdeğerliği göstermek için biyoyararlanım çalışmalarının kullanılamadığı (örneğin yeni ürünün suprabiyoyararlanım gösterdiği yada lokal uygulanan/lokal etkili tıbbi ürün olması) durumlarda,
- Referans tıbbi ürüne kıyasla etkin madde/maddelerde veya terapötik endikasyonda veya yitilikte veya farmasötik şekilde veya uygulama yolunda farklılık olduğu durumda yapılır.
Hibrit ürün bilgisinin dayandığı tıbbi ürün; Gümrük Birliği alanında 6 yıldan az olmayacak bir süre için ruhsatlandırılmış bir tıbbi üründür.
Referans alınan tıbbi ürün, hibrit ürün ile aynı etkin maddeleri içermelidir ve tam bir dosya olarak ruhsatlandırılmış bir ürün olmalıdır.
Başvuru türüne ilişkin detaylar ve gerekçeler CTD Modül 1 Bölüm 1.5.2.’de verilmelidir.
Bu başvuru sırasında uygun preklinik testlerin veya klinik çalışmaların sonuçlarının sunulması zorunludur. Dolayısı ile bu uygulamalar, kısmen bir referans ürün için verilen klinik öncesi testlerin ve klinik çalışmaların sonuçlarına ve kısmen de yeni ek verilere dayanacaktır ve bu durum, Kurum tarafından bilimsel değerlendirme konusu olacaktır.
Bu çerçevede yapılan başvuruda gerekli olan ek çalışmaların kapsamı, referans tıbbi ürüne göre yapılan (yeni bir doz, yeni bir uygulama şekli, yeni bir endikasyon gibi) değişikliklere bağlıdır.
Aşağıdaki tabloda mezkur yönetmeliğin hibrit başvuru ve çeşitleme başvuruları için gerekli olabilecek bazı çalışmalarına yer verilmiştir:
|
Ek veri gerektirenler |
Farklı tuz/ester kompleksi/türevleri (aynı terapötik etkili kısmı ile) |
Etkin maddenin baz kısmının güvenlilik/etkililik profilini önemli ölçüde değiştirebilecek olan farmakokinetik, farmakodinamik ve/veya toksisite verilerinde herhangi bir değişiklik olmadığına dair kanıt sunulması (aksi takdirde yeni bir etkin madde olarak kabul edilir) |
|
Farklı uygulama yolu/farmasötik şekil (paranteral uygulama için, intraarteriyel, intravenöz, intramuskuler, subkutan ve diğer uygulama yollar arasındaki ayrımı yapmak gereklidir) - Yeni bir uygulama yolu ise - Yeni bir farmasötik şekil ise (aynı uygulama yolu)(modifiye edilmiş ise) |
Klinik data (güvenlilik, etkililik), farmakokinetik, eğer gerekli ise preklinik (lokal toksisite) veriler |
Farklı dozda ise (aynı uygulama yolu/farmasötik şekil ve pozolojide) |
Biyoeşdeğerlik çalışmaları sunulmalıdır |
|
Suprabiyoyararlanım gösteren ürünler ise - Azaltılmış dozlar ile aynı zamanda aynı plazma/kan konsantrasyonlarını elde etmeyi amaçlayan aynı dozaj aralıklarında uygulanan |
Biyoyararlanım çalışmaları yeterli olabilir |
Etkin maddenin farklı bir oranda/farklı bir pozoloji ile ilişkilendirilmiş olması durumunda veya bir veya daha fazla etkin madde için değiştirilmiş salım amaçlanmış ise |
Biyoyararlanım çalışmalarını da içeren, mevcut/yeni oran veya doz rejimini karşılaştıran klinik çalışmalar sunulmalıdır |
Ayrıca bu başvuru türü, uygun biyorarlanım çalışmaları ile biyoeşdeğer olduğunu göstermesi mümkün olan fakat başvuru sahiplerinin biyoeşdeğer olduğunu gösteren çalışma sonuçlarını sunamadığı durumlarda kullanılmamalıdır.
İlgililere önemle duyurulur.
Modül 1.2 İdari Bilgiler Başvuru Formu.doc için tıklayınız
Başvuru Sahiplerine Bildiri.pdf için tıklayınız
Sağlık Aktüel - www.saglikaktuel.com
YASAL UYARI: Yayınlanan köşe yazısı/haberin tüm hakları Sağlık Aktüel’e (www.saglikaktuel.com) aittir. www.saglikaktuel.com biçiminde aktif bağlantı kurulabilir, açık kaynak gösterilmek kaydıyla içerik kullanılabilir. Açık kaynak göstermeden yapılan alıntılar için yasal işlem uygulanacaktır.
 Kırklareli'nde öğrenciler ailelerine kanser taraması için çağrıda bulunduKırklareli'nde minik öğrenciler ailelerini kanser taraması için sağlık kuruluşlarına davet etti.28 Mart 2025 Cuma 10:58KANSER
Kırklareli'nde öğrenciler ailelerine kanser taraması için çağrıda bulunduKırklareli'nde minik öğrenciler ailelerini kanser taraması için sağlık kuruluşlarına davet etti.28 Mart 2025 Cuma 10:58KANSER Niğde İl Sağlık Müdürü İnan'dan Ramazan Bayramı'nda sağlıklı beslenme önerisiNiğde İl Sağlık Müdürü Dr. Öğretim Üyesi Doğan Bahadır İnan, Ramazan Bayramı ve sonrası için sağlıklı beslenme önerilerinde bulundu.28 Mart 2025 Cuma 10:53BESLENME VE DİYET
Niğde İl Sağlık Müdürü İnan'dan Ramazan Bayramı'nda sağlıklı beslenme önerisiNiğde İl Sağlık Müdürü Dr. Öğretim Üyesi Doğan Bahadır İnan, Ramazan Bayramı ve sonrası için sağlıklı beslenme önerilerinde bulundu.28 Mart 2025 Cuma 10:53BESLENME VE DİYET Sağlık Bakanı Memişoğlu, AK Parti Çorum İl Başkanlığının vefa iftarına katıldı:Sağlık Bakanı Kemal Memişoğlu, "Sağlıkta tam bağımsız bir Türkiye uğrunda kararlılıkla çalışacak, milletimizden aldığımız güçle, 'Küresel sağlıkta lider Türkiye' hedefine ilerleyeceğiz." dedi.27 Mart 2025 Perşembe 20:14SAĞLIK BAKANLIĞI
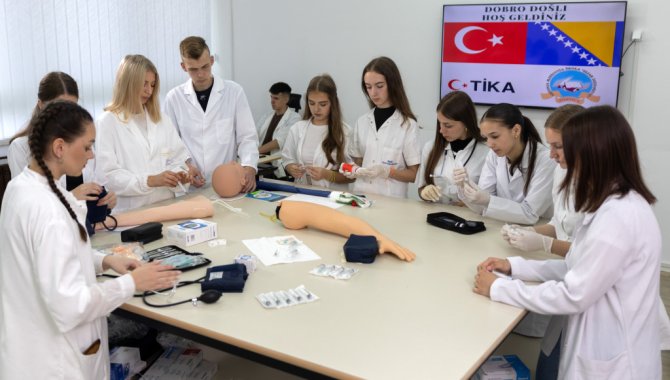
Sağlık Bakanı Memişoğlu, AK Parti Çorum İl Başkanlığının vefa iftarına katıldı:Sağlık Bakanı Kemal Memişoğlu, "Sağlıkta tam bağımsız bir Türkiye uğrunda kararlılıkla çalışacak, milletimizden aldığımız güçle, 'Küresel sağlıkta lider Türkiye' hedefine ilerleyeceğiz." dedi.27 Mart 2025 Perşembe 20:14SAĞLIK BAKANLIĞI TİKA'dan Bosna Hersek'te sağlık eğitimine destekTürk İşbirliği ve Koordinasyon Ajansı Başkanlığı (TİKA) tarafından Saraybosna Üniversitesi Sağlık Bilimleri Fakültesine biyokimya laboratuvarı kuruldu.27 Mart 2025 Perşembe 19:23DÜNYADA SAĞLIK
TİKA'dan Bosna Hersek'te sağlık eğitimine destekTürk İşbirliği ve Koordinasyon Ajansı Başkanlığı (TİKA) tarafından Saraybosna Üniversitesi Sağlık Bilimleri Fakültesine biyokimya laboratuvarı kuruldu.27 Mart 2025 Perşembe 19:23DÜNYADA SAĞLIK ABD Sağlık Bakanlığı 10 bin çalışanını işten çıkarmayı planlıyorABD Sağlık ve İnsan Hizmetleri Bakanlığı, Başkan Donald Trump yönetiminin federal hükümeti küçültme planı kapsamında 10 bin çalışanının işine son vereceğini açıkladı.27 Mart 2025 Perşembe 18:28DÜNYADA SAĞLIK
ABD Sağlık Bakanlığı 10 bin çalışanını işten çıkarmayı planlıyorABD Sağlık ve İnsan Hizmetleri Bakanlığı, Başkan Donald Trump yönetiminin federal hükümeti küçültme planı kapsamında 10 bin çalışanının işine son vereceğini açıkladı.27 Mart 2025 Perşembe 18:28DÜNYADA SAĞLIK Dalaman'da Meslek Yüksekokulu öğrencilerine "Psikolojik Dayanıklılık" eğitimi verildiDalaman İlçe Sağlık Müdürlüğü ve Dalaman Gençlik Merkezi işbirliğiyle,27 Mart 2025 Perşembe 18:03RUH SAĞLIĞI VE HASTALIKLARI
Dalaman'da Meslek Yüksekokulu öğrencilerine "Psikolojik Dayanıklılık" eğitimi verildiDalaman İlçe Sağlık Müdürlüğü ve Dalaman Gençlik Merkezi işbirliğiyle,27 Mart 2025 Perşembe 18:03RUH SAĞLIĞI VE HASTALIKLARI T.C.Kimlik Kartı İle Elektronik Kimlik Doğrulama Yöntemi-9 (Biyometrik Kimlik Doğrulama Sistemi)-27.03.2025Sosyal Güvenlik Kurumu Başkanlığı tarafından Türkiye Cumhuriyeti Kimlik Kartı İle Elektronik Kimlik Doğrulama Yöntemi (Biyometrik Kimlik Doğrulama Sistemi) hakkında duyuru-9 yayımlandı.27 Mart 2025 Perşembe 17:25BİYOMETRİK KİMLİK DOĞRULAMA
T.C.Kimlik Kartı İle Elektronik Kimlik Doğrulama Yöntemi-9 (Biyometrik Kimlik Doğrulama Sistemi)-27.03.2025Sosyal Güvenlik Kurumu Başkanlığı tarafından Türkiye Cumhuriyeti Kimlik Kartı İle Elektronik Kimlik Doğrulama Yöntemi (Biyometrik Kimlik Doğrulama Sistemi) hakkında duyuru-9 yayımlandı.27 Mart 2025 Perşembe 17:25BİYOMETRİK KİMLİK DOĞRULAMA T.C.Kimlik Kartı İle Elektronik Kimlik Doğrulama Yöntemi-8 (Biyometrik Kimlik Doğrulama Sistemi)-27.03.2025Sosyal Güvenlik Kurumu Başkanlığı tarafından Türkiye Cumhuriyeti Kimlik Kartı İle Elektronik Kimlik Doğrulama Yöntemi (Biyometrik Kimlik Doğrulama Sistemi) hakkında duyuru-8 yayımlandı.27 Mart 2025 Perşembe 17:17BİYOMETRİK KİMLİK DOĞRULAMA
T.C.Kimlik Kartı İle Elektronik Kimlik Doğrulama Yöntemi-8 (Biyometrik Kimlik Doğrulama Sistemi)-27.03.2025Sosyal Güvenlik Kurumu Başkanlığı tarafından Türkiye Cumhuriyeti Kimlik Kartı İle Elektronik Kimlik Doğrulama Yöntemi (Biyometrik Kimlik Doğrulama Sistemi) hakkında duyuru-8 yayımlandı.27 Mart 2025 Perşembe 17:17BİYOMETRİK KİMLİK DOĞRULAMA Sağlık Bakanı Memişoğlu Çorum'da ziyaretlerde bulunduSağlık Bakanı Kemal Memişoğlu, Çorum'da ziyaret ve incelemelerde bulundu.27 Mart 2025 Perşembe 15:13SAĞLIK BAKANLIĞI
Sağlık Bakanı Memişoğlu Çorum'da ziyaretlerde bulunduSağlık Bakanı Kemal Memişoğlu, Çorum'da ziyaret ve incelemelerde bulundu.27 Mart 2025 Perşembe 15:13SAĞLIK BAKANLIĞI Muğla'da bayram tatilinde ziyaretçilerin güvenliği için tedbirler artırıldıRamazan Bayramı tatilinde yoğunluk yaşanması beklenen Muğla'da, kent sakinleriyle ziyaretçilerin tatillerini huzur ve güven ortamında geçirmeleri için önlemler artırıldı.27 Mart 2025 Perşembe 15:03BASIN HABERLERİ
Muğla'da bayram tatilinde ziyaretçilerin güvenliği için tedbirler artırıldıRamazan Bayramı tatilinde yoğunluk yaşanması beklenen Muğla'da, kent sakinleriyle ziyaretçilerin tatillerini huzur ve güven ortamında geçirmeleri için önlemler artırıldı.27 Mart 2025 Perşembe 15:03BASIN HABERLERİ
- Geri
- Ana Sayfa
- Normal Görünüm
- © 2006 Sağlık Aktüel