GENVOYA-STRİBİLD DOKTOR MEKTUBU
Sağlık Bakanlığı Türkiye İlaç ve Tıbbî Cihaz Kurumu tarafından Genvoya-Stribild doktor mektubu yayımlandı.

27 Mayıs 2019 Pazartesi 15:55
24.05.2019
GENVOYA (elvitegravir/kobisistat/emtrisitabin/tenofovir alafenamid)
STRIBILD (elvitegravir/kobisistat/emtrisitabin/tenofovir disoproksil)
GEBELİĞİN İKİNCİ VE ÜCÜNCÜ TRİMESTERİNDE DAHA DÜŞÜK
ELVİTEGRAVİR VE KOBİSİSTAT MARUZİYETİ NEDENİYLE TEDAVİ
BAŞARISIZLIĞI RİSKİNDE ARTIŞ VE HIV ENFEKSİYONUNUN ANNEDEN
ÇOCUĞA BULAŞMA RİSKİNDE ARTIŞ
Sayın Hekim,
Bu mektubun amacı, gebeliğin ikinci ve üçüncü trimesterinde daha düşük elvitegravir ve kobisistat maruziyeti sebebiyle, tedavi başarısızlığı riski ve HIV enfeksiyonunun anneden çocuğa bulaşma riski hakkında sizleri bilgilendirmektir.
Bu mektup, T.C. Sağlık Bakanlığı Türkiye İlaç ve Tıbbi Cihaz Kurumu Farmakovijilans ve Kontrole Tabi Maddeler Dairesi ile mutabık kalınarak hazırlanmıştır. Mektuba, vvwvv.titck.gov.tr adresinden de ulaşabilirsiniz.
Özet
- Gebelik sırasında elvitegravir/kobisistat ile tedavi başlatılmamalıdır.
- Elvitegravir/kobisistat ile tedavi sırasında gebe kalan kadınlar alternatif bir tedavi rejimine geçirilmelidirler.
- Bunun sebebi, gebeliğin ikinci ve üçüncü trimesterlerinde, farmakokinetik verilerin daha düşük kobisistat ve elvitegravir maruziyetleri göstermiş olmasıdır.
- Daha düşük elvitegravir maruziyeti, tedavi başarısızlığı riskinde artış ve HIV enfeksiyonunun anneden çocuğa bulaşma riskinde artışla ilişkili olabilir.
Güvenlilik sorunu üzerine ayrıntılı bilgiler
Yapılan bir farmakokinetik çalışmada (TMC114HIV3015; A Sîngle-arm, Open-label, Study to Assess the Pharmacokinetics of Darunavir and Ritonavir, Darunavir and Cobicistat, Etravirine, and Rilpivirine in HIV-1 Infected Pregnant Women) gebelik sırasında kobisistat ile güçlendirilmiş darunavire daha düşük düzeyde maruz kalınması sebebiyle tedavi başarısızlığı riskinde ve HIV enfeksiyonunun anneden çocuğa bulaşma riskinde artış olduğu gösterilmiştir.
Bu sebeple, elvitegravir/kobisistat içeren tedavilerde bu durumun ortaya çıkma riski de incelenmiştir. IMPACT PI026s (International Matemal Pediatric Adolescent AIDS Clinical Trials) çalışmasından elde edilen farmakokinetik veriler, eşleştirilmiş postpartum verilerle kıyaslandığında;
- kobisistat ile güçlendirmiş elvitegravir kullanımından 24 saat sonra plazma konsantrasyonunun ikinci trimesterde %81 ve üçüncü trimesterde %89 daha düşük olduğunu göstermiştir.
- kobisistat kullanımından 24 saat sonra plazma konsantrasyonunun ikinci ve üçüncü trimesterde sırasıyla %60 ve %76 daha düşük olmuştur.
- virolojik olarak baskılanan gebe kadınların oranı, ikinci trimesterde %76.5, üçüncü trimesterde %92.3 ve postpartumda %76 olmuştur.
Bu prospektif çalışmadan alınan veriler, diğer klinik çalışmalardan gebelik vakaları, Gilead global veri tabanı ve yayınlanan literatürden alınan veriler incelenmiş ve gebeliğin ikinci ve üçüncü trimesterlerinde elvitegravir/kobisistat içeren rejimleri alan kadınlarda anneden çocuğa herhangi bir HIV-I bulaşma vakası tanımlanmamıştır.
Elvitegravir maruziyetinde azalma, virolojik başarısızlık ve HIV enfeksiyonunun anneden çocuğa bulaşma riskinde artışa neden olabilir. Bu sebeple, elvitegravir/kobisistat ile tedavi gebelik sırasında başlatılmamalıdır ve elvitegravir/kobisistat ile tedavi sırasında gebe kalan kadınlar alternatif bir rejime geçirilmelidirler.
Genvoya ve Stribild isimli ilaçların kısa ürün bilgileri bu öneriler doğrultusunda güncellenecektir.
Raporlama Gerekliliği
Elvitegravir/kobisistat içeren ilaçlar reçete edilirken yukarıda belirtilen hususlara dikkat edilmesi ve söz konusu ilaçların kullanımı sırasında advers reaksiyon oluşması durumunda T.C. Sağlık Bakanlığı, Türkiye İlaç ve Tıbbi Cihaz Kurumu, Farmakovijilans ve Kontrole Tabi Maddeler Dairesi, Türkiye Farmakovijilans Merkezi’ne (TÜFAM) (e-posta: tufam@titck.gov.tr; faks: 0312 218 35 99; tel: 0312 218 30 00, 0800 314 00 08) ve/veya Gilead Sciences İlaç Tic. Ltd. Şti’ye e- posta (turkey.safety@gilead.com) veya telefon aracılığı ile (tel: 0216 559 03 22) bildirilmesi gerekmektedir.
Saygılarımızla,
GİLEAD SCIENCES İLAÇ TİCARET LTD. ŞTİ.
Şebnem GİRGİN | Ezc. Sena AKBAŞ İlaç Güvenliliği Direktörü Farmakovijilans Yetkilisi Gilead Sciences İlaç Tic.Ltd.Şti. |
▼ Bu İlaç ek izlemeye tabidir. Bu üçgen yeni güvenlilik bilgisinin hızlı olarak belirlenmesini sağlayacaktır. Sağlık mesleği mensuplarının şüpheli advers reaksiyonlarını bildirmeleri beklenmektedir. Raporlama yapılması, ilacın yarar/risk dengesinin sürekli olarak izlenmesine olanak sağlamaktadır.
Sağlık Aktüel - www.saglikaktuel.com
YASAL UYARI: Yayınlanan köşe yazısı/haberin tüm hakları Sağlık Aktüel’e (www.saglikaktuel.com) aittir. www.saglikaktuel.com biçiminde aktif bağlantı kurulabilir, açık kaynak gösterilmek kaydıyla içerik kullanılabilir. Açık kaynak göstermeden yapılan alıntılar için yasal işlem uygulanacaktır.
 Seydişehir'de sağlık personeline eğitim verildiSeydişehir ilçesinde sağlık müdürlüğü personeline ilk yardım eğitimi yapıldı.22 Nisan 2025 Salı 13:18SAĞLIK BAKANLIĞI
Seydişehir'de sağlık personeline eğitim verildiSeydişehir ilçesinde sağlık müdürlüğü personeline ilk yardım eğitimi yapıldı.22 Nisan 2025 Salı 13:18SAĞLIK BAKANLIĞI Van'da ebeler, anne adaylarının doğum korkusunu yenmelerine yardımcı oluyorVan'da görev yapan ebeler, hastanelerde yürüttükleri bilgilendirme faaliyetleriyle anne adaylarının doğum sırasındaki korkularını yenmelerine yardımcı oluyor.22 Nisan 2025 Salı 13:18KADIN HASTALIKLARI VE DOĞUM
Van'da ebeler, anne adaylarının doğum korkusunu yenmelerine yardımcı oluyorVan'da görev yapan ebeler, hastanelerde yürüttükleri bilgilendirme faaliyetleriyle anne adaylarının doğum sırasındaki korkularını yenmelerine yardımcı oluyor.22 Nisan 2025 Salı 13:18KADIN HASTALIKLARI VE DOĞUM Gönüllü gençler 23 Nisan'ı hastanede geçirecek çocuklara bayram coşkusu yaşatıyorDüzce Gençlik Merkezi gönüllüleri, 23 Nisan Ulusal Egemenlik ve Çocuk Bayramı'nı rahatsızlıkları nedeniyle hastanede geçirmek zorunda kalan çocuklara, odalarını süsleyip onlarla oyunlar oynayarak bayram sevinci yaşatıyor.22 Nisan 2025 Salı 12:53BASIN HABERLERİ
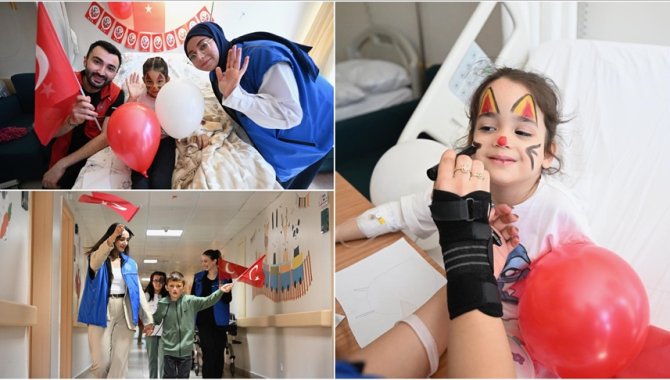
Gönüllü gençler 23 Nisan'ı hastanede geçirecek çocuklara bayram coşkusu yaşatıyorDüzce Gençlik Merkezi gönüllüleri, 23 Nisan Ulusal Egemenlik ve Çocuk Bayramı'nı rahatsızlıkları nedeniyle hastanede geçirmek zorunda kalan çocuklara, odalarını süsleyip onlarla oyunlar oynayarak bayram sevinci yaşatıyor.22 Nisan 2025 Salı 12:53BASIN HABERLERİ Gebe okulunda aldığı eğitimle normal doğumu seçtiİzmir'de ikinci bebeğini sezaryen ile getirmeyi planlayan anne adayı, gebe okulunda anne ve bebek sağlığı konusunda öğrendikleri sonucunda normal doğum yapmaya karar verdi.22 Nisan 2025 Salı 12:23KADIN HASTALIKLARI VE DOĞUM
Gebe okulunda aldığı eğitimle normal doğumu seçtiİzmir'de ikinci bebeğini sezaryen ile getirmeyi planlayan anne adayı, gebe okulunda anne ve bebek sağlığı konusunda öğrendikleri sonucunda normal doğum yapmaya karar verdi.22 Nisan 2025 Salı 12:23KADIN HASTALIKLARI VE DOĞUM Yeryüzü Doktorları Derneği Yönetim Kurulu Başkanı Ahmet Salduz olduYeryüzü Doktorları Derneğinin Olağan Genel Kurulu'nda Prof. Dr. Ahmet Salduz, Yönetim Kurulu Başkanı seçildi.22 Nisan 2025 Salı 12:03DERNEK VE ODALAR
Yeryüzü Doktorları Derneği Yönetim Kurulu Başkanı Ahmet Salduz olduYeryüzü Doktorları Derneğinin Olağan Genel Kurulu'nda Prof. Dr. Ahmet Salduz, Yönetim Kurulu Başkanı seçildi.22 Nisan 2025 Salı 12:03DERNEK VE ODALAR Van'da rahatsızlanan hamile kadın ve karnındaki bebeği, erken müdahaleyle kurtarıldıVan'ın Çatak ilçesinde rahatsızlanan hamile kadın ve karnındaki bebeği, doktorların erken müdahalesi sonucu hayata tutundu.22 Nisan 2025 Salı 11:58KADIN HASTALIKLARI VE DOĞUM
Van'da rahatsızlanan hamile kadın ve karnındaki bebeği, erken müdahaleyle kurtarıldıVan'ın Çatak ilçesinde rahatsızlanan hamile kadın ve karnındaki bebeği, doktorların erken müdahalesi sonucu hayata tutundu.22 Nisan 2025 Salı 11:58KADIN HASTALIKLARI VE DOĞUM Antalya İl Sağlık Müdürü Özkan, hastanede tedavi gören çocukları ziyaret ettiAntalya İl Sağlık Müdürü Prof. Dr. Behzat Özkan, 23 Nisan Ulusal Egemenlik ve Çocuk Bayramı dolayısıyla hastanede tedavi gören çocukları ziyaret etti.22 Nisan 2025 Salı 11:53SAĞLIK BAKANLIĞI
Antalya İl Sağlık Müdürü Özkan, hastanede tedavi gören çocukları ziyaret ettiAntalya İl Sağlık Müdürü Prof. Dr. Behzat Özkan, 23 Nisan Ulusal Egemenlik ve Çocuk Bayramı dolayısıyla hastanede tedavi gören çocukları ziyaret etti.22 Nisan 2025 Salı 11:53SAĞLIK BAKANLIĞI "Yenidoğan çetesi" davasının dördüncü duruşması devam ediyorİstanbul'da bebek acil hastalarını önceden anlaştıkları özel hastanelerin yenidoğan ünitelerine sevk edip ölümlerine neden oldukları ve haksız kazanç sağladıkları öne sürülen 29'u tutuklu 58 sanığın yargılandığı davanın dördüncü duruşması sürüyor.22 Nisan 2025 Salı 11:43BASIN HABERLERİ
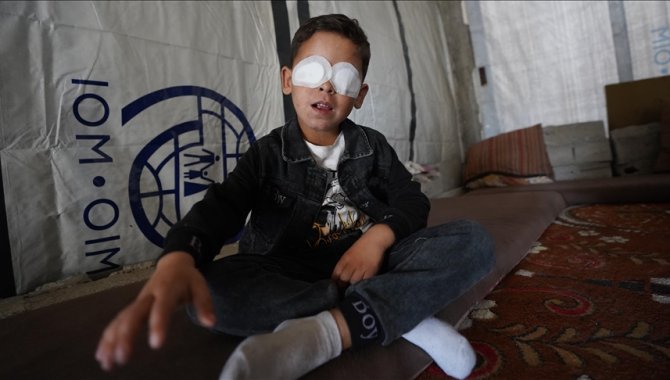
"Yenidoğan çetesi" davasının dördüncü duruşması devam ediyorİstanbul'da bebek acil hastalarını önceden anlaştıkları özel hastanelerin yenidoğan ünitelerine sevk edip ölümlerine neden oldukları ve haksız kazanç sağladıkları öne sürülen 29'u tutuklu 58 sanığın yargılandığı davanın dördüncü duruşması sürüyor.22 Nisan 2025 Salı 11:43BASIN HABERLERİ Gazze’de patlamada bir gözünü kaybeden 7 yaşındaki çocuk, tüm görme yetisini kaybedebilirİsrail'in 7 Ekim 2023'ten bu yana devam eden saldırılarında, patlamamış bir mühimmatın infilak etmesi sonucu 7 yaşındaki Filistinli çocuk bir gözünü kaybetti.22 Nisan 2025 Salı 11:08GÖZ HASTALIKLARI
Gazze’de patlamada bir gözünü kaybeden 7 yaşındaki çocuk, tüm görme yetisini kaybedebilirİsrail'in 7 Ekim 2023'ten bu yana devam eden saldırılarında, patlamamış bir mühimmatın infilak etmesi sonucu 7 yaşındaki Filistinli çocuk bir gözünü kaybetti.22 Nisan 2025 Salı 11:08GÖZ HASTALIKLARI Medipol'den çocukları menenjit hastalığından koruma tavsiyeleriMedipol Bahçelievler Hastanesi Çocuk Sağlığı ve Hastalıkları Uzmanı Prof. Dr. Ahmet Güzel, hızlı ilerleyen ve hayati risk taşıyan bir enfeksiyon hastalığı olan menenjitin erken tanı ve aşılamayla önlenebilir bir hastalık olduğunu aktardı.22 Nisan 2025 Salı 11:08ÇOCUK SAĞLIĞI VE HASTALIKLARI
Medipol'den çocukları menenjit hastalığından koruma tavsiyeleriMedipol Bahçelievler Hastanesi Çocuk Sağlığı ve Hastalıkları Uzmanı Prof. Dr. Ahmet Güzel, hızlı ilerleyen ve hayati risk taşıyan bir enfeksiyon hastalığı olan menenjitin erken tanı ve aşılamayla önlenebilir bir hastalık olduğunu aktardı.22 Nisan 2025 Salı 11:08ÇOCUK SAĞLIĞI VE HASTALIKLARI
- Geri
- Ana Sayfa
- Normal Görünüm
- © 2006 Sağlık Aktüel